Introduction
Les interférons (IFN) sont des protéines signal qui aident le corps à combattre les infections en induisant une réponse immunitaire. Dans le cas de la COVID-19, ils semblent jouer un rôle paradoxal. Si des failles préexistantes dans la réponse des IFN ont déjà été associées à un pronostic défavorable, leur administration à des fins thérapeutiques n’améliore pas pour autant les résultats cliniques des personnes atteintes de COVID-19 et pourrait même aggraver leur état. C’est sans compter que, dans sa forme grave, la COVID-19 se caractérise par des taux très élevés d’IFN. Comme les IFN interviennent dans un certain nombre d’infections, il importe de comprendre comment ils influencent la réponse immunitaire pour savoir comment moduler leur action.
Pour répondre à ces questions, nous avons procédé à une analyse intégrée de la signature moléculaire sanguine de personnes hospitalisées pour la COVID-19. Nos résultats révèlent l’existence de quatre sous-groupes distincts et soulignent l’hétérogénéité de la réponse immunitaire au virus. Nous avons notamment identifié un groupe à haut risque qui présente une corrélation entre une réponse inflammatoire exacerbée et un mauvais pronostic. Notre étude montre également que, dans l’ensemble de la cohorte, des taux élevés d’IFN sont associés à une réponse immunitaire différée, ce qui semble indiquer l’existence d’un mécanisme sous-jacent au paradoxe des interférons.
Développement
Nous avons analysé les données de 242 personnes symptomatiques à la COVID-19 dans 2 hôpitaux de Montréal, au Québec (Canada), puis transposé certaines parties de notre analyse aux données de 76 personnes hospitalisées à Uppsala, en Suède. Dans la plupart des études, les patients sont généralement regroupés en fonction de caractéristiques observables pendant l’hospitalisation, ce qui peut fausser la compréhension de certaines maladies fortement évolutives comme la COVID-19. Au lieu de cela, nous les avons regroupés au moyen de l’algorithme de regroupement des k-moyennes fondés sur des signatures moléculaires environ 11 jours après l’apparition des symptômes. L’algorithme PHATE, au cœur de notre analyse, nous a permis de projeter les profils moléculaires en 2D afin de visualiser l’« écart » entre les sujets et les groupes dans l’espace des données.
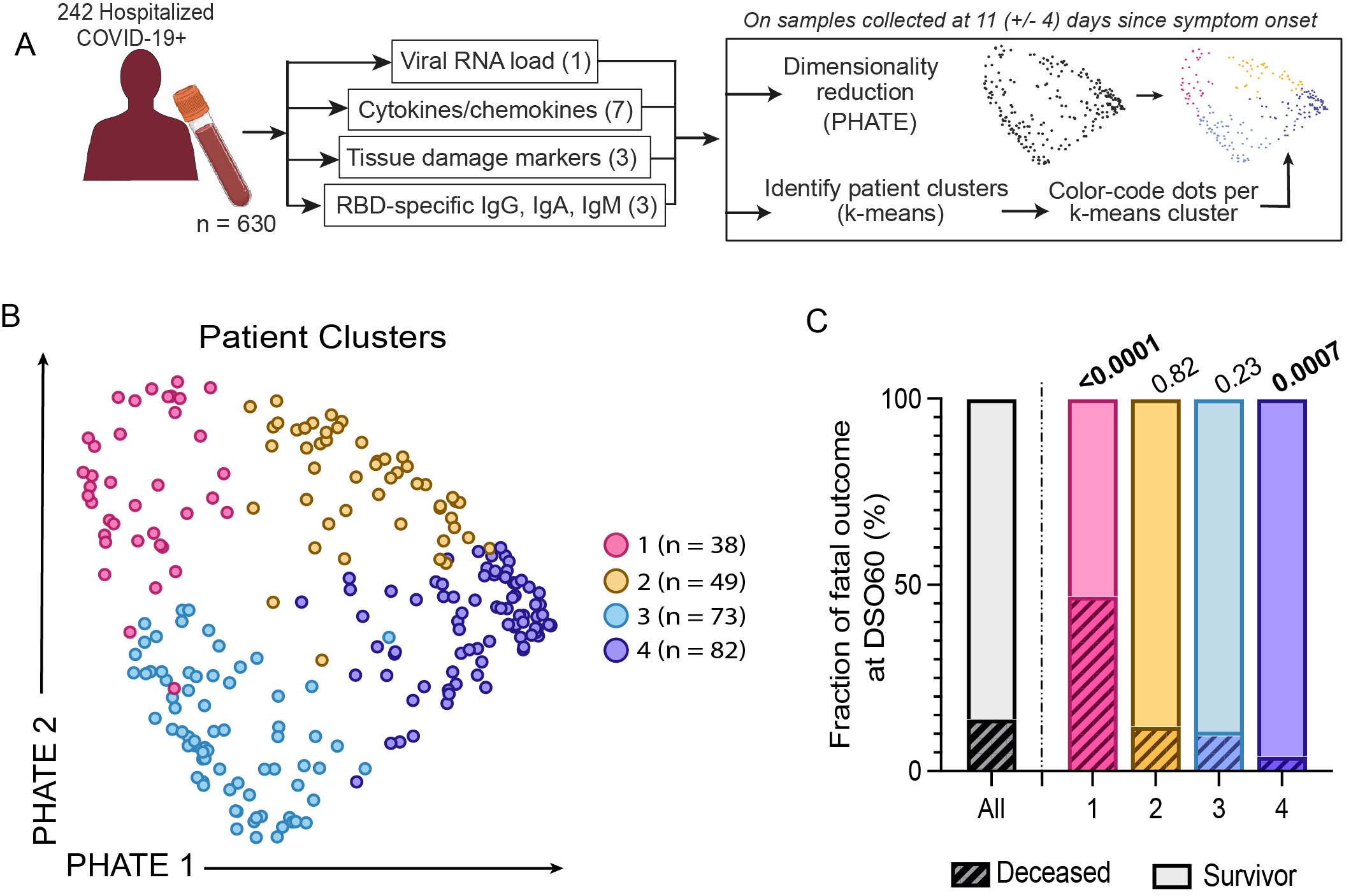
Notre analyse intégrée a mis au jour quatre profils de patients réagissant différemment au virus. Les deux premiers groupes correspondaient à des cas critiques nécessitant une ventilation artificielle, dont l’un comptait un nombre particulièrement élevé de décès. Ce groupe à taux de mortalité élevé présentait des quantités distinctes de particules virales, d’anticorps et de marqueurs de lésions tissulaires. Les deux autres groupes comprenaient des personnes hors de danger et se distinguaient l’un de l’autre par le moment de la réponse immunitaire. Notre caractérisation des patients cadre non seulement avec la gravité de la maladie, mais elle permet également de déterminer les chances de survie dans les cas critiques. La visualisation PHATE reflète certaines de nos constatations : l’axe gauche-droite correspond au moment de la réponse immunitaire, tandis que l’axe descendant correspond à la charge virale et à d’autres marqueurs de la sévérité de la maladie.
Afin d’expliquer la production différée d’anticorps dans le groupe à taux de mortalité élevé et l’un des groupes hors de danger, nous avons examiné les gènes exprimés dans chaque groupe 11 jours après l’apparition des symptômes. Ces personnes présentaient des signatures plus élevées d’IFN, qui étaient également corrélées négativement avec d’autres réponses immunitaires.
Conclusion
Afin d’établir l’échelle de gravité de la maladie chez les personnes hospitalisées pour la COVID-19, nous avons prélevé des échantillons sanguins auprès de plus de 300 personnes à un moment précis de l’évolution de la maladie et mesuré un certain nombre de marqueurs liés à leur réponse immunitaire. Nous avons dégagé quatre « profils » : deux groupes dont l’état n’était pas critique et qui présentaient ou non une réponse immunitaire différée, tous deux ayant bien évolué, et deux groupes dans un état critique, l’un d’eux regroupant la quasi-totalité des décès associés à la COVID-19. Ce groupe à taux de mortalité élevé se distinguait également par la lenteur de sa réponse immunitaire. Les deux groupes ayant présenté ce retard ont maintenu un taux élevé d’IFN pendant une plus longue période, ce qui a également été associé à la lenteur d’autres réponses immunitaires. Nos résultats représentent la première caractérisation chez l’humain du « paradoxe des interférons », selon lequel l’ampleur et le moment de la réponse des IFN jouent un rôle déterminant dans l’obtention d’une réaction immunitaire adaptée. Cette étude apporte une explication aux résultats apparemment contradictoires concernant l’IFN en lien avec la COVID-19 et a des implications pour le traitement de cette maladie, mais peut-être aussi d’autres infections virales.
Références
Brunet-Ratnasingham, Elsa et coll. « Sustained IFN signaling is associated with delayed development of SARS-CoV-2-specific immunity », Nature Communications, vol. 15, no 1, 2024, p. 4177.